Periampuller kanserler tüm GİS kanserlerinin % 5’ini oluşturur. 5 yıllık ortalama survi % 1-10. Pankreas kanseri (pankreas kanalından) GİS Ca.ların % 2/si. Ampuller kanser (ampulla vateri mukozasından). Distal kolanjiosellüler kanser (koledok distalinden). Duodenal adenokarsinom (duodenum). Pankreatikoduodenektomi spesmenlerinin incelenmesinde; % 40-60 pankreas Ca, % 10-20 ampuller Ca, %10 safra yolu Ca, %5-10 duodenum Ca, % 10-20 benign hastalıklar. Pankreatik periampuller kanser rezektabilitesi daha düşük olduğu için periamp.kanserlerin % 80-90’ı pankreas kanseri kabul edilebilir.
Periampuller kanserler:
Pankreas kanserine göre prognozları daha iyidir. Rezeksiyon sonrası 5 yıllık survi % 30-40. Pankreas karsinomunda rezektabilite oranı % 20. Periampuller karsinomda % 80 (rezeksiyon yapılanların sadece % 30’unda lenf nodu metastazı. Papilla kanserinde kolon Ca gibi adenom-karsinom ilişkisi gösterilmiştir.
Klinik: Pankreas başı kanserine benzer. Safra yolu ve ampuller kanserde erken semptom sarılık. Duodenal karsinom; duodenum obstrüksiyonu, üst GİS kanaması.
Tanı: CT veya US. Periampüller neoplazm şüphesi; Üst Gİ endoskopi, biyopsi. Distal safra yolu karsinomu; ERCP (pankreatik kanal tutulumu yoktur). Cerrahi öncesi evrelendirme için; kontrast CT veya MRI.
Tedavi: Rezektabl periampuller karsinomlar; genellikle PPPD, peripankreatik lenf nodu diseksiyonu. Küçuk ampüller kanserler (1cm) veya perivaterian adenomlar; ampullektomy. Nonrezektabl neoplazmlar; cerrahi bypass; hepatikojejunostomi, koledokojejunostomi, gastrojejunostomi. Endoskopik veya transhepatik stent; metastaz varlığı kesin + sarılık. Pankreatikoduodenektomi sonrası 5 yıllık sürvi % 30.
Pankreas neoplazmları:
Son 60 yılda görülme sıklığı artmıştır. Pankreas hastalıklarının 1/3’ünü oluşturur. Sıklık sırası: duktal adenokarsinom % 80, periampuller veya ampuller kanser, endokrin pankreas neoplazmları.
Benign pankreas tümörleri: Seyrek, çoğu endokrin sistemden kaynaklanır. Benign ekzokrin tümörler; seröz kistadenom,müsinöz kistadenom, solid psödopapiller neoplazm. Pankreasın her yerinde, en çok gövde ve kuyrukta. 40-60 yaş bayanlarda en sık. Asemptomatik, atipik karın ağrısı. Yavaş seyirli. Tedavisi cerrahi, etkilenen bölümün eksizyonu.
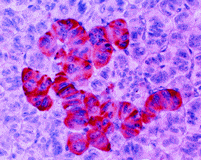 Malign pankreas tümörleri: Endokrin sistemden; insülinoma, gastrinoma, vipoma, glukagonoma, nesidioblastosi. Ekzokrin sistemden; duktal pankreatik karsinom (%80), giant cell karsinom, kistadenokarsinom, asiner hücre karsinom, IPMN (intraduktal papilller müsinöz neoplazm). % 30’u invaziv kansere dönüşür. Görülme sıklığı artmaktadır (pankreas kanseri rezeksiyonlarının %10-15’i). Klinik olarak asemptomatik veya atipik-kronik pankreatit kiniği gibi. Konnektif dokudan; leiomyosarkom, histiositom, nörojenik neoplazmlar veya metastazlar. Çok nadir görülürler.
Malign pankreas tümörleri: Endokrin sistemden; insülinoma, gastrinoma, vipoma, glukagonoma, nesidioblastosi. Ekzokrin sistemden; duktal pankreatik karsinom (%80), giant cell karsinom, kistadenokarsinom, asiner hücre karsinom, IPMN (intraduktal papilller müsinöz neoplazm). % 30’u invaziv kansere dönüşür. Görülme sıklığı artmaktadır (pankreas kanseri rezeksiyonlarının %10-15’i). Klinik olarak asemptomatik veya atipik-kronik pankreatit kiniği gibi. Konnektif dokudan; leiomyosarkom, histiositom, nörojenik neoplazmlar veya metastazlar. Çok nadir görülürler.
Pankreas kanseri tüm GI kanserler içinde tanıda gecikmenin fazla olduğu ve tedaviye rağmen ölüm oranlarının en yüksek olduğu kanser olmaya devam etmektedir. Retroperitoneal lokalizasyonu nedeniyle pankreas tümörlerinin tanısı diğer GİS tümörlerinin tanısından daha zordur. Preoperatif tanı için biyopsi alınması diğer GİS tümörlerinden daha zordur. BT, endoskopik US ve ince iğne aspirasyon biyopsileri preoperatif doku tanısına ulaşmada kullanılır hale gelmiştir. Ortalama görülme yaşı 65’tir. Hastaların yaklaşık %80’i 60 yaş ve üzerindedir. 30 yaşında insidans 100.000’de 0.1, 80 yaşında 200. Uzun yıllar erkeklerde fazla görülmesi ile Akciğer Ca’ya benzer. Erkeklerde daha sık: 1.5-2.1. Kadınlarda sigara içiminin artması ile kadın erkek arasındaki fark kapanmaktadır. Mevcut eğri devam ederse birkaç dekat sonra insidans kadın ve erkekte eşit olacak. Afrika kökenli Amerikalılarda Pankreas Ca sıklığı beyazlardan %50 daha fazladır. Bunun nedeni, sigara dumanındaki kanserojenlerin detoksifiye edilmesindeki ırka ait bozukluk olabilir.
Pankreas Ca için en büyük risk faktörü sigaradır: Bütün kanserlerin yaklaşık 1/3 ‘ünde neden sigaradır. Günde bir paket sigara içimi Pankreas Ca riskini 2 kat artırmaktadır. Alkolizm pankreatit için majör risk faktörüdür (çalışmalarda alkol alımı ile P Ca. arasında ilişki gösterilememiş), pankreatitte ise Pankreas Ca riski artmaktadır. Alkol + sigara genellikle birlikte tüketilmektedir.
Diyet kuvvetli bir risk faktörü olmasa da, yağ, hayvansal protein ve kalori alımının artması, taze sebze ve meyve tüketiminin azalması Pankreas Ca riskini artırmaktadır. 1981’de kahve kullanımı ile pankreas CA arasında kuvvetli ilişkide bahsedilmiş ancak daha sonra bunun kahve içenlerin genellikle iyi bir sigara tiryakisi olmaları ile açıklamışlar. Pankreatitten Pankreas ca gelişimini destekleyen çalışmalar vardır.
 Bilier pankreatitin rolü son derece azdır. Kronik pankreatitte zamanla Ca riski artmaktadır; 10 yılda risk %2, 20 yılda risk %4 ‘dür. DM için aile hikayesi olmayan, zayıf,40 yaşın altındaki hastada diabet ortaya çıkması pankreas Ca’ların erken semptomu olabilir. Diabet pankreas Ca için bir risk faktörüdür (özellikle tanıdan 3 yıl önce ortaya çıktı ise). Uzun süreli karsinojenlerle (azaserine, nitrosamine veya diğer) tedaviler. Pankreas Ca ‘da kalıtımsal geçişin %10 kadar olduğu varsayılır. BRCA2…..13. kromozomda lokalize (BRCA1’de risk yok) BRCA2 taşıyanlarda pankreas Ca riski normal popülasyondan 3.5 kat fazladır. Bir veya daha fazla 1. derece akrabalarda pankreas Ca olması kuvvetli bir risk faktörüdür.
Bilier pankreatitin rolü son derece azdır. Kronik pankreatitte zamanla Ca riski artmaktadır; 10 yılda risk %2, 20 yılda risk %4 ‘dür. DM için aile hikayesi olmayan, zayıf,40 yaşın altındaki hastada diabet ortaya çıkması pankreas Ca’ların erken semptomu olabilir. Diabet pankreas Ca için bir risk faktörüdür (özellikle tanıdan 3 yıl önce ortaya çıktı ise). Uzun süreli karsinojenlerle (azaserine, nitrosamine veya diğer) tedaviler. Pankreas Ca ‘da kalıtımsal geçişin %10 kadar olduğu varsayılır. BRCA2…..13. kromozomda lokalize (BRCA1’de risk yok) BRCA2 taşıyanlarda pankreas Ca riski normal popülasyondan 3.5 kat fazladır. Bir veya daha fazla 1. derece akrabalarda pankreas Ca olması kuvvetli bir risk faktörüdür.
Herediter pankreatit: otozomol dominant geçen bir hastalıktır ve pankreatitlerin %1-2’sinden sorumludur. Kromozom 7q35 bandında defekt vardır. Pankreas Ca riski normalden 53 kat fazladır. Herediter pankreatitlerde 70 yaşında pankreas Ca ihtimali %40’dır. Sigara içimi bu riski artırmaktadır. Familial pankreas kanseri riski Beta karoten,COX 2 inhibitörleri veya sigarayı bırakmakla azaltılabilir.
Pankreas Ca’dan korunma: Sigara içiminin önlenmesi, yağ tüketiminin önlenmesi, obesitenin önlenmesi, taze sebze ve meyve tüketiminin artırılması. Herediter pankreatitlerde uygun tarama yöntemleri kullanımı (endo US, spiral CT vs).
Moloküler biyoloji ve genetik: primer pankreas neoplazileri 2’ye ayrılabilir, ekzokrin differansiasyon gösterenler ve endokrin differansiyasyon gösterenler. En sık ekzokrin differansiyasyon gösteren tip infiltratif duktal adenokarsinomdur. En sık görülen kromozom değişiklikleri (daha çok delesyon şeklinde): p16 tümör süpresyon genin bulunduğu 9p kromozomunda kopma, p53 genin bulunduğu 17 p kromozomda kopma, DPC4 genin bulunduğu 18q kromozomunda kopma. Ayrıca; insanlardaki pankreas duktal adenokarsinomlarının %90’dan fazlasında K-ras (KRAS2) geninde artmış nokta mutasyonu bulunur. Pankreatik duktal karsinomlarda mutasyona uğramış tümör-supresör genler; p16, p53, DPC4, TGF-B I ve II, BRCA2.
Daha az sıklıkla görülenler; MKK4, LKB1/STK11 (Peutz- Jegher’s Sendromunda pankreas ca riski 24 kat artmıştır). Pankreas ca’da sıklıkla görülen kaşeksi, iştah kaybı, anabolizma azalması ve yağ-protein katabolizmasının artışı sistemik mediatörlerle izah edilmektedir. Pankreas Ca Pan IN-1 (pankreatik intraepitelial neoplazi) başlayarak gelişir. Pan IN-1 ise duktus kolumnar epitelinin proliferasyonu ile oluşmaktadır. K-ras mutasyonu Pan In-1‘de bile sıklıkla erkenden orataya çıkmaktadır. p16 gen değişikliği intermediate evrede (Pan IN-2) gözlenir. p53 geninde aşırı ekspresyon, DPC4 geninde ekspresyon kaybı ve BRCA 2 ekspresyon kaybı genellikle neoplazi gelişiminin geç evresinde (Pan IN-3) ortaya çıkar. Bu gen çalışmalarının amacı, hastalığı erken evrede saptamak ve gelecekte alternatif tedavilerin kurulmasını sağlamaktır.
Tümör biyolojisi gereği özellikle intrapankreatik sinir kılıflarına invazyon yapar; sırt ağrısı. 2/3’ünde lenfatik invazyon. Hematojen yayılım da %80 KC metastazı. Diğer met.yerleri; AC, periton yüzeyi, adrenal bezler, böbrekler, plevra, iskelet.
Başvuru şikayetleri: Pankreas başı tümörlerde tıkanma sarılığı semptom ve bulguları. Korpus ve kuyruk tümörlerinde uzamış nonspesifik semptomlar. Bulantı, iştahsızlık, erken doyma, barsak alışkanlığında değişiklik gibi GİS semptomları tanıda gecikmeye sebep olur. Karın ve sırta vuran ağrı. Kilo kaybı. %25’den azında palpable kitle veya asit vardır.
Laboratuar testleri: Karaciğer fonksiyon testleri ve serum amilazı genellikle normal. CA 19-9 yükselebilir ancak sensitif ve spesifik değildir. 500 IU/L üzerindeki artış invazif duktal adenokarsinomu kuvvetle düşündürmelidir.
Klinik evrelendirme amacı:
 Küratif amaçlı rezeksiyon adaylarını veya agresif lokorejionel tedavi alacak olanları belirlemektir. Cerrahi explorasyon doğru evreleme sonrası rezektable olduğu düşünülen olgularda veya cerrahi palyasyon yapılacak vakalarda uygulanmalıdır. Önceleri ağrısız sarılığı, karın ağrısı veya karında kitlesi olan hastalara PTK ve endoskopi yapılır ve primer patoloji ile rezektablite şansı ameliyatta değerlendirilirdi. Bugün için spiral ve helikal CT’nin kullanılması ile preop doğru evreleme yapılabilmektedir. Explorasyonda periton yüzeyi, KC, retroperitoneal LN ve kan damarlarının diseksiyonu değerlendirilir.
Küratif amaçlı rezeksiyon adaylarını veya agresif lokorejionel tedavi alacak olanları belirlemektir. Cerrahi explorasyon doğru evreleme sonrası rezektable olduğu düşünülen olgularda veya cerrahi palyasyon yapılacak vakalarda uygulanmalıdır. Önceleri ağrısız sarılığı, karın ağrısı veya karında kitlesi olan hastalara PTK ve endoskopi yapılır ve primer patoloji ile rezektablite şansı ameliyatta değerlendirilirdi. Bugün için spiral ve helikal CT’nin kullanılması ile preop doğru evreleme yapılabilmektedir. Explorasyonda periton yüzeyi, KC, retroperitoneal LN ve kan damarlarının diseksiyonu değerlendirilir.
Unrezektabilite kriterleri: 1-Uzak metastaz (peritoneal, KC veya nodal). 2-Sup. mezenterik arter, hepatik arter veya T. çölyakus invazyonu. 3-Portal venin uzun segment tutulumu. Mide, kolon ve duodenumun invazyonu kontraendikasyon değildir. Porta hepatiste, transvers mezokolon kökünde veya çölyak bölgede metastatik LN varsa tümör rezektabile bile olsa evre IVB’dir. Pankreas CA’lı hastaların %80’i lokal veya uzak ilerlemiş hastalık ile başvurmaktadır. Sağ kalımı sınırlı hastalarda exploratris cerrahi anlamlı perioperatif morbidite, mortalite ve azalmış QOL İle birliktedir.
Kolanjiografi: Ağrısız sarılığı olan hastalarda başlangıç ve önemli inceleme metodu olmaya devam etmektedir. ERCP safra yolları ve pankreatik kanalı inceleme imkanı verir. Endoskopik veya transhepatik yaklaşımda tanı için hücre alınabilir. Kalıcı veya geçici stent yerleştirilebilir. ERCP veya PTK rezektabilitenin değerlendirmesinde faydasızdır.
CT: Metastatik hastalığın tanısında son derece kıymetlidir. İlerlemiş hastalığı olanlarda CT eşliğinde biyopsi doku tanısını koydurabilir. KC’de 1 cm’nin üzerindeki metastazlar CT ile saptanabilir. CT’de sup. Mezenterik arter, çölyak veya hepatik arterler çevresindeki yağlı planların temiz görünmesi ile rezektabilite kararı verilir. CT’de portal venin %50’den daha az tutulması ve Sup. Mezenterik ven ile jejunal dalların açık olması rezektable portal ven sınırını gösterir. CT’de çölyak , portal, paraaortik veya sup. Mezenterik LN 1 cm’nin üzerindeki kitle görünümü unrezektable hastalığı gösterir. Pankreas posteriorundaki yağlı plan invazyonu unrezektable hastalığı gösterir. Spiral CT anjiografi üç boyutlu olarak peripankreatik damarların değerlendirilmesine imkan verir ve klasik anjiografiye gerek kalmaz. Pankreas tümörlerin evrelendirilmesinde CT standart metod haline gelmiştir.
MR: Pankreas CA evrelemesinde kullanılır. Pankreas tümörleninin çoğu T1 ağırlıklı görüntülerde hipointens görülür. IV. Gadolinium kullanıldığında küçük pankreatik tümörler enjeksiyonun erken fazında hipointens olarak görülür. MRI tüm pankreas CA olgularında değil de CT’de rezektable görünen olguların değerlendirilmesinde kullanımı önerilmiştir. MRCP ile ERCP veya PTK’da elde edilen görüntüleri temin etmek mümkündür.
Endoskopik US: Pankreas Canın rutin evrelemesinde klasik transabdominal USnin yeri yoktur. T ve N değerlendirilmesinde EUS son derece faydalıdır ve CT’den üstündür. Damar invazyonunun değerlendirmesinde de CT’den üstündür. EUS’nin bu üstünlüğüne rağmen unrezektabilitenin değerlendirmesinde CT EUS’den daha kıymetli bulunmuştur.
Flourodeoxyglikoz ile PET: Florin 18 ile işaretlenmiş Flourodeoxyglikoz iv verildiğinde metabolizması yüksek olan tümör dokusu tarafından tutulmaktadır. PET evrelemede kullanılmaz ancak CT ve MR’da kesin karar verilemeyen lezyonların karakterini saptamada kullanılır. PET primer tümörü ortaya konmasında CT’den daha üstün iken , lokal rezektabilite hakkında ilave bilgi sağlamaz. PET metastatik hastalığın gösterilmesinde de faydalıdır.
Laparoskopi ve laparoskopik US: Spiral CT teknolojisindeki ilerlemelere rağmen bugün halen pek çok hasta rezeksiyon yapılamayan evreleme laparotomisi almaktadır. Bu gereksiz laparotomi yerine laparoskopi uygun bir metoddur. Cerrahi dışındaki tedavi yöntemlerinde kür şansı olmadığı için Memorial Sloan Kattering kanser merkezinde preop evrelemede CT ve laparoskopi öncelikli olarak kullanılmaktadır. Laparoskopi sadece evrelemede değil , doku tanısına ulaşmayı da sağlar. Preop evrelemede laparoskopinin yerini tartışanlar çok az hastanın küratif veya palyatif cerrahiye ihtiyacı olmadığını, dolayısıyla zaten cerrahi uygulanacak hastanın laparoskopiye ihtiyacı olmadığını belirtiyorlar. Cerrahi dışı palyasyon yöntemleri de olduğu için bu görüşe katılmak mümkün değildir. Laparoskopi gereksiz laparotomiyi engellemektedir. Unrezektabl olgularda safra drenajı cerrahi dışı yöntemlerle başarılı bir şekilde temin edilebildiğinden, palyatif cerrahi daha çok gastroduodenal obstrüksiyonda kullanılmaktadır. CT ve MRI teknolojisindeki ilerlemeler sayesinde, bugün Pankreas Ca evrelemesinde karın US, kolanjiografi ve anjiografinin yeri son derece sınırlıdır veya yoktur.
————————————————-
Pankreas Ca’da Patoloji: Pankreasın primer tümörlerinin çoğu maligndir ve duktal adenokarsinom tipindedir. Duktal Adeno Ca ABD’de en sık görülen 5. kanserdir ve kanser ölümlerinde ise 4. sıradadır. Pankreas tümörleri genellikle solid ve sklerotik özelliktedir. Olguların pekçoğunda tümörü çevreleyen pankreas dokusundaki sklerozan pankreatit nedeniyle tümör ile neoplastik olmayan pankreası birbirinden ayırmak imkansızdır. Pankreasın kistik tümörleri genellikle daha az agresiftir. Pankreas tümörlerinde kist oluşum mekanizmaları; luminal sekresyon, dejenerasyon, mevcut kanallarda ektazi. İntraduktal papiller müsinöz neoplaziler için endoskopide papilla vateriden müsin gelmesi tipik endoskopi bulgusudur. Müsinöz kistik neoplaziler tek multiloküler kistten oluşur ve genellikle pankreasın kuyruk kısmına yerleşir.
Klinik: Sarılık; idrar renginde koyulaşma, gaita renginin açılması, kilo kaybı ve kaşıntı ile birliktedir. Koledoğun intrapankreatik kısımda tıkanmasına bağlıdır. Karın veya bel ağrısı (progressiftir). %10’unda ilk bulgu DM. Etyolojik neden (safra taşı, alkol) belli olmayan yaşlıda pankreatit görülmesi. Bulantı, kusma. Nadiren anemi (GİS erezyonuna bağlı lümene kan kaybı).
FM:Skleralaarda ve ciltte sarılık, hepatomegali, safra kesesinin ağrısız ele gelmesi (Courvoisier Terrier belirtisi), kaşınmaya bağlı deride irritasyon, kaşeksi ve adele kaybı. Lenf nodu metastazı ve peritoneal yayılım (Virchow nodülü, Sister Marry Joseph nodülü, Blumer’s shelf).
Laboratuar:Pankreas başı Ca: Serum direk ve total bilüribin seviyesinde artış, alkalen fosfataz ve gama glutamil transferazda artış, SGOT-SGPT’de hafif yükselme. Pankreas korpus ve kuyruk Ca; Lab değerleri genellikle normal, bozulan karaciğer fonksiyon testleri diffüz karaciğer metastazını veya portahepatis tutulumunu gösterir, bilüribin yüksek ise safra tuzları enterohepatik dolaşıma geçemez ve K vit’e bağlı pıhtılaşma faktörlerinde azalma olur. Hepatit markerleri genellikle negatiftir.
CA 19-9 da artış (Pank.Ca’ların %75-80’inde yüksektir). CA 19-9 prognoz ve tümör rekürrensinin değerlendirilmesinde de faydalıdır. CA 19-9’un aşırı yüksekliği tm büyüklüğü ve unrezektabilite ile paralellik göstermektedir. Düşmesi ise iyi prognozun göstergesidir. SPAN-1, CA-50, DUPAN-2, elastaz-1, doku polipeptit antijeni gibi diğer tümör markerları CA 19-9’un doğruluk oranına ulaşamamıştır. Duodenal pankreatik sıvıdan, gaitadan veya İİAB materyalinden K-ras proto-onkojen tayini tanıda faydalıdır. Pankreas Ca’ların %90’dan fazlasında K-ras proto-onkojeni saptanır.
Tanıda görüntüleme metodları: Standart US (perkütan), CT, MRI, MRCP, ERCP, PTK, endo US, PET. US, sarılıklı hastada safra kesesi taşı tanısında en hassas test olamaya devam etmektedir. Perkütan US intra ve ekstrahepatik safra yollarının görüntülenmesi, KC metastazı, pankreasta kitle, asit ve nadiren peripankreatik lenf nodlarının görüntülenmesinin sağlayabilir. Tümörün lokalizasyonu, çevre dokularla ilişkisi, majör damarların değerlendirilmesini büyük oranda sağladığı için CT, tanıda ve tedavinin planlanmasında çok faydalıdır. ERCP ve PTK’nın sağladığı görüntülerin MRCP ile temini önemli noninvazif bir tanı metodu halini almasını sağladı. Gelişmiş merkezlerde tanı amaçlı ERCP’nin yerini MRCP almıştır. Ancak palyatif amaçlı stent yerleştirilmesi ancak ERCP veya PTK (özellikle proksimal anatominin değerlendirilmesini sağlar) ile mümkün olmaktadır. Endo US, özellikle 3 cm’den küçük lezyonların değerlendirilmesinde CT ve MR’dan daha üstün bulunmuştur.
Pankreas Ca’ da tedavi:
1-Palyatif; nonoperatif, operatif. 2-Rezeksiyonel.
Nonoperatif palyasyon: Uzak metastazı olan, unrezektable lokal hastalık veya dissemine intraabdominal tümörlerde non-operatif tedavi tercih edilir. Anestezi ve cerrahi yapılamayacak kadar genel durumu bozuk hastalarda da nonoperatif tedavi uygulanır. Safra yollarının açılması ve ağrı için genellikle nonoperatif palyasyon uygun iken tümöre bağlı gastroduodenal obstrüksiyonda daha çok tercih edilen operatif gastrojejunostomi işlemidir.
Safra yolu tıkanıklığı: Pankreas Ca’da hastaların büyük kısmı sarılık ile başvurur ve tedavi edilmezse ilerleyici KC yetmezliği, KC disfonksiyonu ve ölüme kadar gidebilir. Kaşıntı da önemli bir problemdir. Öncelikle endoskopik stent yerleştirilmesi ile veya gerekli olduğunda perkütan stent yerleştirilmesi ile bu sorun çözülebilir. Endoskopik stent yerleştirilmesinin komplikasyonları; erken (kolanjit, hiperamilazemi, pankreatit, safra yolu veya duodenum perferasyonu), geç (stent migrasyonu, stent tıkanması, kolesistit ve geç duodenal peferasyondur). Sağ kalım beklentisi olan hastalarda stent proflaktik olarak 3-6 ay aralıklarla değiştirilir. Metalik expandible stentlerde bu süre uzayabilir. Perkütan stent yerleştirilmesinin komplikasyonları; hemobilia, safra peritoniti, safra ile plevral efüzyon, kolanjit, pankreatit ve akut kolesistittir.
Ağrı: Karın ve sırt ağrısı sıklıkla karşılaşılan ve hastalık ilerledikçe zor kontrol edilen bir semptomdur. WHO’nun 3 basamaklı analjezik tedavisi uygulanır. Nonnarkotik hafif analjeziklerden başlanır ve narkotik analjeziklere kadar uzanır. Ayrıca perkütan çöliak sinir blokajı, external radyoterapi, torakoskopik splanknikektomi uygulanır.
Duodenum obstrüksiyonu: Pankreas Ca’ya bağlı gerçek duodenal obstrüksiyon sık değildir. Bulantı, kusma, erken doyma gibi şikayetleri olan hastaların 1/3’ünde kısmı mekanik obstrüksiyon vardır. Genellikle cerrahi gastrojejunostomi ile, son zamanlarda bilier tip metalik stentlerle endoskopik olarak darlık ortadan kaldırılabilir.
Operatif palyasyon: Tüm preoperatif evreleme yöntemleri kullanılması ile en iyi merkezlerde pankreas ca’da rezektabilite oranı %60-90 arasında bildirilmektedir. Rezektif cerrahi en uzun sağ kalım şansına sahip tedavi yöntemidir. Palyatif cerrahi; safra yolu tıkanıklığının ortadan kaldırılması, mevcut ya da muhtemel duodenal obstrüksiyonun engellenmesi ve tümöre bağlı ağrının palyasyonuna yönelik olmalıdır.
Safra yolu tıkanıklığı: Başlıca 3 yöntemle ortadan kaldırılabilir; hepatiko veya koledokojejunostomi, kolesistojejunostomi, koledokoduodenostomi. Anastomozun tümöre yakınlığı nedeniyle koledokoduodenostomi pek tercih edilmez. Kolesistojejunostominin çalışmama ihtimali %15-20’ler civarındadır. Bundan da kaçınılmalıdır. En iyi yöntem hepatiko veya koledokojejunostomidir. Bu da ya bir defonksiyone jejunum ansı ile (Braun anastomozlu) veya Roux-n-Y ansı ile çözülür. Roux-n-Y anastomozun pratik ve teorik avantajları vardır.
Duodenal obstrüksiyon: Pankreas başı Ca’larda duodenumun 2. kısmında, korpus Ca’da treitz ligamenti seviyesinde ortaya çıkar. Hastalığın seyri esnasında %20 olguda gastrojejunostomi ihtiyacı ortaya çıkmaktadır. Laparotomi almış olgularda unrezektable tümörlerde proflaktik gastrojejunostomi tavsiye edilmektedir. Treitz’den yaklaşık 20-30 cm mesafeden jejunum ansı ile retrokolik gastrojejunostomi ugulanır. Vagotomi ilave edilmesi tavsiye edilmez (geç mide boşalması).
Ağrı palyasyonu: için intraoperatif kimyasal splanknikektomi (%50 alkol enjeksiyonu) yapılmalıdır. Çöliak trunkusun çevresine aortanın her iki yanına alkol enjeksiyonu yapılır. Nonoperatif palyasyon yapılan bir seride ortalama sağ kalım 6,5 ay iken, rezektable hastalarda bu süre 21 ay olarak bildirilmiştir.
Rezektif tedavi: Periampüller bölge tümörleri için ilk başarılı ampulla Ca’nın lokal rezeksiyonunu 1898’de William Stewart Halsted yapmıştır. Kansch 1912’de duodenum ve pankreasın bir kısmını başarılı şekilde çıkarmıştır. Whipple ve arkadaşları 1930-40’larda kendi ismi ile anılan operasyonu popülarize etmiştir. 1970’lerin sonunda ise pilor koruyucu pankreatikoduodenektomi tekrar popülarize olmuştur. Operasyonda önce rezektabilite değerlendirilir. KC, omentum ve büyümüş lenf nodları değerlendirilir.
Kocher manevrası yapılarak superior mezenterik damarlar invazyon açısından incelendikten sonra rezeksiyona karar verilir. Vena porta invazyonu da yoksa, duodenumun tamamı, pankeasın baş ve unsinat prosesi, antrumu içerecek rezeksiyon yapılır.(Whipple op.) Pilor koruyucu ameliyat yapılacaksa antrum korunur, duodenum pilordan 2 cm distalden kesilir. Pankreas korpus ve kuyruk tümörlerinde distal pankreatektomi + splenektomi uygulanır ve duodenum yerinde bırakılır. Rekonstrüksiyon için önce pankreas anastomozu, takiben safra kanalı ve son olarak mide veya duodenum anastomozları yapılır.
————————————————————
Komplikasyonlar: 1950-60’larda mortalite oranı %25’ler civarında iken bugün %1-3 mortalite ile bu ameliyat uygulanabilmektedir. Postoperatif en sık erken ölüm nedenleri sepsis, kanama ve kardiovasküler olaylardır. Bugün mortalitenin düşürülmesine rağmen komplikasyon oranı %50’ler civarındadır. Whipple ameliyatından sonra en sık görülen problem olan geç mide boşalması eritromisin verilerek çözülebilir. Pankeas fistülünü önlemek için rutin oktreotid kullanımına gerek yoktur. Whipple ameliyatından sonra reoperasyon gerektirecek ciddi komplikasyon gelişme oranı %5’den azdır. 1, 3 ve 5 yıllık sağkalım oranları sırasıyla %57, %26 ve %21 olarak bildirilmiştir.(Johns Hopkins Hst sonuçları). Yaş tek başına Whipple ameliyatı için bir kontrendikasyon olarak düşünülmemelidir. Pankreas korpus ve kuyruk tümörleri daha geç tanı aldığı için operasyonda genellikle büyük tümör kitlesi ile karşılaşılmakta ve rezektabilitesi daha düşük olabilmektedir. Adjuvan radyoterapi-kemoterapi özellikle lokal ilerlemiş veya unrezektable hastalarda kullanılır. Genellikle 50-60 Gy’lık doz dikkatli şekilde uygulanmalıdır. Kemoterapide pek çok kombinasyon denenmiş en etkili olanları 5FU ve son yıllarda Gemsitabin bulunmuştur. Ancak kemoterapinin sağ kalıma katkısı ancak aylarla ifade edilmiştir. Neoadjuvan yapılan kemo-radyasyonun postoperatif uygulanan adjuvan kemo-radyasyonuna üstünlüğü gösterilememiştir.
YAZIYI PAYLAŞ


 Safra kesesi hastalıkları ve taşı neden olur? Belirtileri ve tedavisi
Safra kesesi hastalıkları ve taşı neden olur? Belirtileri ve tedavisi Stent nedir? Kimlere, nasıl takılır? Faydaları ve riskleri
Stent nedir? Kimlere, nasıl takılır? Faydaları ve riskleri Pankreas kanseri neden olur? Belirtileri ve tedavisi
Pankreas kanseri neden olur? Belirtileri ve tedavisi 10 soruda stent uygulaması hakkında merak edilen herşey
10 soruda stent uygulaması hakkında merak edilen herşey Akut Pankreatit tanı ve tedavisi
Akut Pankreatit tanı ve tedavisi
YORUMUNUZ VAR MI?